Выявление риска, связанного с попаданием антибиотиков в организм человека, можно оценить, измерив суточное потребление и отметить проявления их влияния в виде двух реакций на организм: неблагоприятной лекарственной реакции и хронической токсичности. Длительное употребление антибиотиков может вызвать серьезные побочные эффекты, такие как аллергия, проблемы с пищеварением, заболевания почек и хронические болезни, например, сердечно-сосудистые заболевания. К примеру, частое назначение фторхинолонов, которые ранее считались безопасными антибиотиками, привело к развитию синдрома, известного как фторхинолоновая инвалидизация, от побочных эффектов которого пострадали тысячи людей во всем мире. Кроме того, в исследовании утверждается, что безопасность окружающей среды и здоровье населения находятся под серьёзной угрозой из-за высокотоксичного антибиотика энрофлоксацина, поскольку в исследовании оценивались побочные эффекты энрофлоксацина и его производных.
Чтобы понять взаимосвязь между регулярным использованием антибиотиков и ростом устойчивости к ним, необходимо правильно понимать взаимодействие антибиотиков с различными средами (водой, воздухом, почвой), социальными группами (фермерами, животными, птицей и т. д.), процессами (сельское хозяйство, транспортировка, хранение и т. д.) и способами использования человеком (приготовление и потребление пищи).
Основная функция антибиотиков — борьба с бактериями, поэтому когда бактерии подвергаются воздействию антибиотиков в течение длительного времени, они эволюционируют и вырабатывают иммунитет к определённым антибиотикам. В 2015 году сообщалось, что у таких патогенов, как кишечная палочка (E. coli), развилась устойчивость к таким антибиотикам, как аминогликозиды (26%), аминопенициллины (87%), амоксициллин (65%), карбапенемы (15%), цефалоспорины (78%), фторхинолоны (78%) и глицилциклины (1%). Кроме того, сообщалось, что изоляты Salmonella typhi устойчивы к аминопенициллинам (5%), фторхинолонам (68%), макролидам (6%) и триметоприму (5%), в то время как только устойчивость к фторхинолонам среди Salmonella typhi выросла с 8 до 28% с 2008 по 2014 год. С другой стороны, снижается устойчивость к противомикробным препаратам, которые не так часто используются, таким как триметоприм сульфаметоксазол и аминопенициллин.
Устойчивость к фторхинолонам тревожно возросла с 28% в 2010 году до 68% в 2015 году. Эта проблема не связана с конкретным регионом, она затрагивает людей по всему миру.
В штате Карнатака было проведено исследование для выявления чувствительности к антибиотикам с целью поиска потенциальных видов, устойчивых к антибиотикам, и чувствительности к антибиотикам, которая наблюдалась в исследовании в отношении тетрациклинов и фторхинолонов из-за их чрезмерного использования в качестве профилактических препаратов и стимуляторов роста. Кроме того, устойчивость к тетрациклинам наблюдалась у всех 187 изолятов кишечной палочки. Более того, в общей сложности 176 видов бактерий E. coli (94 %) были устойчивы как к ципрофлоксацину, так и левофлоксацину, тогда как 6% изолятов были чувствительны к обоим препаратам. Кроме того, только 36 изолятов (19 %) были устойчивы к цефотаксиму и цефтазидиму. Устойчивость к ампициллину наблюдалась у 18 (90%) из 20 изолятов клебсиелл, за которыми следовали ципрофлоксацин, левофлоксацин (по 80%) и тетрациклин (80%). Все 20 изолятов клебсиелл демонстрировали множественную лекарственную устойчивость. Около 40% E. coli были устойчивы к амикацину, цефотаксиму, офлоксацину и карбапенемам, а всеизоляты E. coli были устойчивы к меропенему. Некоторые не смогли устоять перед дозировкой хлорамфеникола, цефтриаксона, цефепима, цефуроксима, гентамицина, левофлоксацина, норфлоксацина и нитрофурантоина.
Развитие устойчивости к антибиотикам может быть связано с различными механизмами. Например, одним из таких механизмов является ограничение доступа к антибиотикам, когда пептидогликан действует как защитный слой снаружи плазматической мембраны вокруг большинства бактериальных клеток, защищая их от внешней среды.
Другой механизм заключается в откачивании антибиотиков из клеточной стенки, патогены заставляют свои клеточные стенки выводить антибиотики, которые попадают в клетку (рис.1). Некоторые антибиотики, такие как хлорамфеникол, фторхинолоны, триметоприм и бета-лактамные антибиотики, выводятся из клеточной стенки.
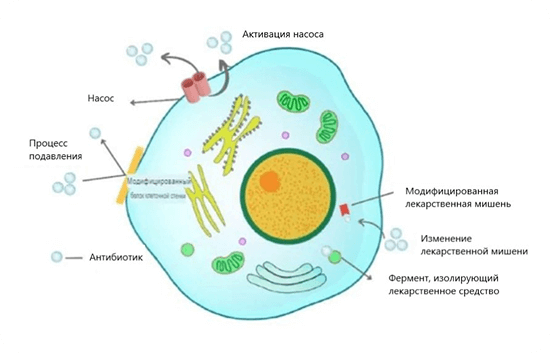
Рис. 1. Схематическое изображение общего механизма устойчивости к антибиотикам
Третий механизм — изменение или разрушение антибиотиков, когда бактерии, такие как Klebsiella pneumoniae, вырабатывают ферменты, называемые карбапенемазами, которые расщепляют карбапенемы и большинство бета-лактамных антибиотиков.
Бактерии также могут вырабатывать устойчивость к антибиотикам, изменяя место прикрепления антибиотиков, например, кишечная палочка с геном mcr1 способна добавлять дополнительное вещество к внешней стороне клеточной стенки, чтобы препарат колистин не мог воздействовать на неё.
Некоторые бактерии могут вырабатывать новые клеточные процессы, которые обходят действие антибиотиков, например, могут вырабатывать процесс, который подавляет действие триметоприма и изменяет его мишень. Помимо устойчивости к антибиотикам, остатки антибиотиков в окружающей среде вызывают и другие последствия в организме человека и животных, как показано в (Таблице 1).
Таблица 1. Уровни устойчивости к различным антибиотикам в окружающей среде.
| Тип устойчивости к противомикробным препаратам (AMR) | Тип патогена | Сопротив-ление (%) | Задействованные антибиотики | |
| AMR у людей | Грамотрица-тельные бактерии | Кишечная палочка, Клебсиелла пневмонии и Ацинетобактер бауманнии | >70 | Фторхинолоны и цефалоспорины третьего поколения |
| Синегнойная палочка | ≥50 | |||
| Кишечная палочка и P. aeruginosa | <35 | Пиперациллин-тазобактум | ||
| Грам-положительные организмы | Золотистый стафилококк | 43 | Метициллин | |
| Enterococcus faecium | 10.5 | Ванкомицин | ||
| Сальмонелла брюшного тифа | 28 | Ципрофлоксацин | ||
| 0.6 | Цефтриаксон | |||
| 2.3 | Ко-тримоксазол | |||
| Шигелла | 82 | Ципрофлоксацин | ||
| 12 | Цефтриаксон | |||
| 80 | Ко-тримоксазол | |||
| Холерный вибрион | 17–75 | Тетрациклин | ||
| AMR у с/х животных | Грамотрица-тельные организмы | Бациллы (в коровьем и буйволином молоке) | 47.5 | Окситетрациклин |
| Грамположительные организмы | Золотистый стафилококк (в коровьем и буйволином молоке) | 2.4 | Ванкомицин | |
| Золотистый стафилококк | 21.4 | Метициллин | ||
| Коагулазонегативные стафилококки | 5.6 | |||
| АМР у рыб | Холерный вибрион и V. parahaemolyticus | 100 | Ампициллин | |
| 100 | Хлорамфеникол | |||
| 67–96 | Цефтазидим | |||
| AMR у домашней птицы | Виды сальмонелл (бройлеры) | 100 | Ципрофлоксацин, гентамицин и тетрациклин | |
| AMR в окружающей среде | E. coli | Бытовая вода | 25 | Цефалоспорин третьего поколения |
| Бытовые отходы и больничные стоки | 70 | |||
| Больничные стоки | 95 | |||
В молочном животноводстве вопрос применения антимикробного препарата для лечения мастита стоит очень остро. Как выбрать эффективный антибиотик и не «залечить» животных, действуя наугад?
Аналитическим подходом в лечении мастита является обоснованных выбор антимикробного препарата, в зависимости от чувствительности к нему выявленных возбудителей.
Важным и практически необходимым исследованием для ветеринарного врача при диагностике и лечении мастита остается бактериологический посев.
А именно:
Перечень активных живых возбудителей Чувствительность к антибиотикам, которые в дальнейшем применяются для лечения мастита.
Руководствуйтесь принципами рациональной антибиотикотерапии:
Как в лабораториях ветеринарной диагностики и клинической микробиологии ЛИЦ «Агроплем» помогают выработать правильный подход к лечению мастита:
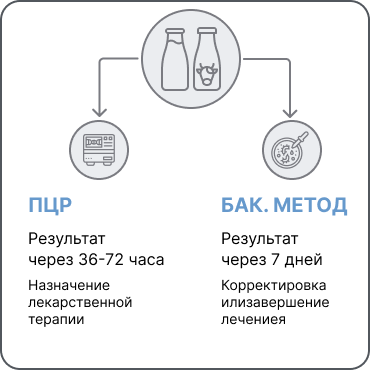
36–72 ч
Результат с перечнем обнаруженных патогенов (из списка) и их относительным (в крестах) содержанием в пробе для первичного выбора антибиотика
48–72 ч
результат с перечнем обнаруженных генов резистентности бактерий к антибиотикам
ОПЕРАТИВНАЯ КОРРЕКТИРОВКА ЛЕЧЕНИЯ, НАЗНАЧЕНИЕ ТЕРАПИИ
7 дней
результат бак посева с результатами чувствительности к антибиотикам — ≥5-ти выделенных возбудителей (40-ка стандартных антибиотиков и/или комплексные коммерческие препараты)
КОРРЕКТИРОВКА ИЛИ ЗАВЕРШЕНИЕ ЛЕЧЕНИЯ